Transmissionselektronenmikroskopie: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Posch (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 204: | Zeile 204: | ||
==In-situ-Mikroskopie== | ==In-situ-Mikroskopie== | ||
Die Vielfalt der strukturellen Details in [[Kunststoffe]]n bedingt eine Mannigfaltigkeit in den nano- und mikromechanischen Prozessen unter Belastung. Diese umfassen Veränderungen auf der Ebene der Makromoleküle (auf der nm-Skala), lokalisierte plastische Prozesse wie [[Crazing]] und Scherfließen (auf der μm-Ebene) bis zu [[Rissausbreitung]] und dem makroskopischen [[Bruch]] (auf der mm-Ebene). Daher gibt es verschiedene Techniken zur Untersuchung dieser Prozesse, die in '''Bild 15''' skizziert sind. Es gibt drei Hauptrichtungen:<br> | Die Vielfalt der strukturellen Details in [[Kunststoffe]]n bedingt eine Mannigfaltigkeit in den nano- und mikromechanischen Prozessen unter Belastung. Diese umfassen Veränderungen auf der Ebene der Makromoleküle (auf der nm-Skala), lokalisierte plastische Prozesse wie [[Crazing]] und [[Scherbandbildung|Scherfließen]] (auf der μm-Ebene) bis zu [[Rissausbreitung]] und dem makroskopischen [[Bruch]] (auf der mm-Ebene). Daher gibt es verschiedene Techniken zur Untersuchung dieser Prozesse, die in '''Bild 15''' skizziert sind. Es gibt drei Hauptrichtungen:<br> | ||
{| | {| | ||
|-valign="top" | |-valign="top" | ||
| Zeile 236: | Zeile 236: | ||
|-valign="top" | |-valign="top" | ||
|[1] | |[1] | ||
|Michler, G. H.: Electron Microscopy of Polymers. Springer Verlag, Berlin Heidelberg (2008) (ISBN 978-3-54036350-7; siehe [[AMK-Büchersammlung]] unter F 1) | |[[Michler,_Goerg_Hannes|Michler, G. H.]]: Electron Microscopy of Polymers. Springer Verlag, Berlin Heidelberg (2008) (ISBN 978-3-54036350-7; siehe [[AMK-Büchersammlung]] unter F 1) | ||
|-valign="top" | |-valign="top" | ||
|[2] | |[2] | ||
Version vom 14. Mai 2020, 13:50 Uhr
| Ein Service der |
|---|

|
| Polymer Service GmbH Merseburg |
| Tel.: +49 3461 30889-50 E-Mail: info@psm-merseburg.de Web: https://www.psm-merseburg.de |
| Unser Weiterbildungsangebot: https://www.psm-merseburg.de/weiterbildung |
| PSM bei Wikipedia: https://de.wikipedia.org/wiki/Polymer Service Merseburg |
Transmissions-Elektronenmikroskopie (TEM)
Funktionsweise eines TEM
Konventionelle TEM
Die Realisierung des Gedankens, mittels Elektronenstrahlen vergrößerte Abbildungen herzustellen, wurde zuerst 1931 unabhängig von zwei Forschergruppen realisiert: M. Knoll und E. Ruska (TH Berlin, magnetischer Typ des TEM) sowie E. Brüche und H. Johannsen (AEG-Forschungsinstitut Berlin, elektrostatischer Typ des TEM).
Entsprechend der Doppelnatur von Wellen- und Korpuskularstrahlen kann auch den Elektronenstrahlen eine Wellenlänge λ zugeordnet werden. Die Wellenlänge wird durch die Geschwindigkeit der Elektronen und damit durch die verwendete Beschleunigungsspannung im TEM bestimmt (λc = h/mev, de Broglie 1924, Tabelle 1). Dementsprechend gelten für die Transmissionselektronenmikroskopie die gleichen Prinzipien wie für die Lichtmikroskopie – das Auflösungsvermögen ist von der Wellenlänge der für die Abbildung verwendeten Energiequelle abhängig. Die Wellenlänge der Elektronenstrahlen liegt etwa um einen Faktor 105 niedriger als die des sichtbaren Lichtes (0,4 – 0,8 μm). Aufgrund der Einschränkung durch Linsenfehler, speziell die sphärische Aberration, liefert das Transmissionselektronenmikroskop tatsächlich aber nur etwa eine um den Faktor 103 höhere Auflösung im Vergleich mit dem Lichtmikroskop. Demzufolge liegt die erreichte Auflösung im Größenbereich von 0,5 nm bis 0,1 nm.
Tabelle 1: Zusammenhang zwischen Beschleunigungsspannung der Elektronen und der resultierenden Wellenlänge λ
| Beschleunigungsspannung (kV) |
Wellenlänge λ (nm) |
|---|---|
| 20 | 0,0086 |
| 40 | 0,0060 |
| 80 | 0,0049 |
| 100 | 0,0037 |
| 200 | 0,0025 |
| 1000 | 0,00087 |
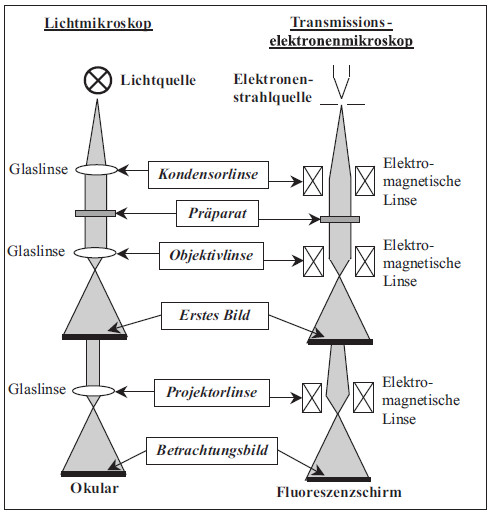
Transmissionselektronenmikroskope sind im Prinzip analog zu den Lichtmikroskopen aufgebaut und bestehen aus hintereinandergeschalteten vergrößernden Linsen (Bild 1). Die aus der Katode heraustretenden Elektronen werden zur Anode hin beschleunigt und außerdem durch den Wehneltzylinder am Ort der Anode gebündelt („Cross Over“). Der divergente Elektronenstrahl wird durch die nachfolgenden elektromagnetischen Linsen (mehrstufiges Kondensorlinsensystem) so fokussiert, dass er die Probe als nahezu paralleler Strahl mit sehr geringer Ausdehnung durchstrahlt. Dies ist eine wesentliche Bedingung für eine hohe Intensität bei der Durchstrahlung des Präparates.
Im Präparat werden die Elektronen mehr oder weniger gestreut, und mittels der durch die Kontrastblende durchgelassenen Strahlen erzeugt die Objektivlinse vom Präparat ein einstufig vergrößertes Bild. Dieses erste Zwischenbild wird nun durch die nachfolgenden Zwischenlinsen und letztlich durch das Projektiv stark vergrößert auf dem Leuchtschirm abgebildet (in dem schematischen Bild 1 sind die Zwischenlinsen nicht eingezeichnet). Der Leuchtschirm wandelt die unsichtbaren Elektronen in sichtbares Licht um. Die Bildaufzeichnung erfolgt über Photoplatten oder eine CCD-Kamera.
Voraussetzung für die Anwendung transmissionselektronenmikroskopischer Methoden ist die Durchstrahlbarkeit der zu untersuchenden Proben. Das bedeutet, dass die Probendicke wegen Absorption und Streuung der Elektronen in der Materie einen bestimmten Wert nicht überschreiten darf, der von der verwendeten Beschleunigungsspannung im Elektronenmikroskop und damit von der Energie der Elektronen abhängt.
| Bild 1: | Schematische Darstellung des Strahlenganges in einem Lichtmikroskop und einem Transmissionselektronenmikroskop |
Für die maximal verwendbare Probendicke kann als Richtwert für Polymere und andere Materialien aus leichten Elementen in erster Näherung abgeschätzt werden:
Die verwendete Probendicke d (in Nanometern) sollte also den zweifachen Wert der im Elektronenmikroskop angelegten Beschleunigungsspannung UB (in kV) nicht überschreiten. Typische Probendicken für die Untersuchung von Polymerproben sind 50 nm bis 250 nm bei 200 kV. Die Präparation solcher Objekte erfordert meist eine aufwändige Präparationstechnik und spezielle Härtungs- und Kontrastierverfahren. Für Semidünn- bzw. Dünnfilme mit mehreren hundert Nanometern Dicke können nur spezielle TEM, sog. Höchstspannungselektronenmikroskope (HEM), eingesetzt werden, deren Beschleunigungsspannungen bis über 1000 kV betragen, und die in der Lage sind, Polymerproben von mehreren Mikrometern Dicke zu durchstrahlen. Zu beachten ist aber, dass mit zunehmender Filmdicke die erreichbare Auflösung abnimmt. Soll eine gleiche Auflösung wie in einem 100 kV-TEM möglich sein, ist der Dickengewinn beim Übergang von 100 kV zu 1000 kV geringer.
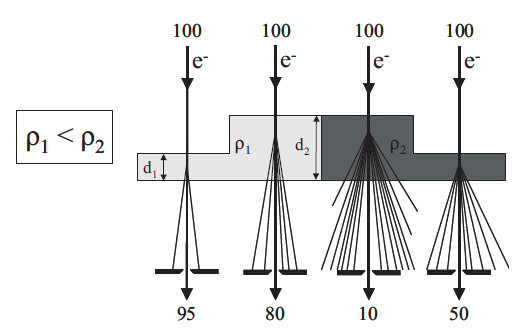
Die Mechanismen der Kontrast- und Bildentstehung sind aufgrund der sehr dünnen Proben komplizierter als bei der Lichtmikroskopie. Für polymere Werkstoffe spielt in den meisten Fällen der Mechanismus des Streuabsorptionskontrastes die entscheidende Rolle. Beim Durchgang der Elektronen durch eine z. B. amorphe Probe tritt eine Streuung der Elektronen an den Atomen der Probe auf. Dies bedeutet, dass von den einfallenden Elektronen ein gewisser Anteil in von der Primärstrahlrichtung abweichende Richtungen abgelenkt wird (Bild 2). Der Anteil der Elektronen, die in große Winkel gestreut werden, ist abhängig von der Ordnungszahl des streuenden Atoms (d. h. der Dichte) und der lokalen Dicke der Probe. Je höher die Ordnungszahl und die Probendicke, desto größer ist der Anteil der in größere Winkel gestreuten Elektronen. Durch eine im unteren Brennpunkt der Objektivlinse angeordnete Blende (Kontrast- oder Aperturblende) werden alle Elektronen zurückgehalten, die in einen Winkelbereich gestreut worden sind, der größer ist als durch die Öffnung der Kontrastblende vorgegeben wird. Diese Elektronen „fehlen“ bei der Bildentstehung auf dem Leuchtschirm bzw. dem Fotomaterial, und es ergibt sich damit ein dunklerer Bildbereich.
Bei Präparaten, die kaum Unterschiede in der Dichte und der Objektdicke aufweisen (z. B. Ultradünnschnitte von mehrphasigen Polymeren), müssen für TEM-Untersuchungen meist selektive Kontrastierverfahren eingesetzt werden. Dabei wird z. B. durch Einlagerung schwerer Atome wie Osmium oder Ruthenium das Streuvermögen einer Phase der Probe deutlich erhöht und damit die Aufklärung der Probenmorphologie ermöglicht. Ein Beispiel einer Kontrastverstärkung durch selektive chemische Kontrastierung der amorphen Bereiche in einem teilkristallinen Polymer zeigt Bild 3.
Übersichten über die verschiedenen Methoden der Elektronenmikroskopie sind in [1 – 15, 19] enthalten.
| Bild 2: | Schematische Darstellung des Streuabsorptionskontrastes im TEM |
| Bild 3: | Isotaktisches Polypropylen (Kurzzeichen: PP) in selektiv chemisch kontrastierten Ultradünnschnitten im TEM Links: α-iPP mit der charakteristischen „Cross-hatched“ Struktur der Lamellen Rechts: β-iPP mit einem Bündel paralleler Lamellen |
Elektronenbeugung
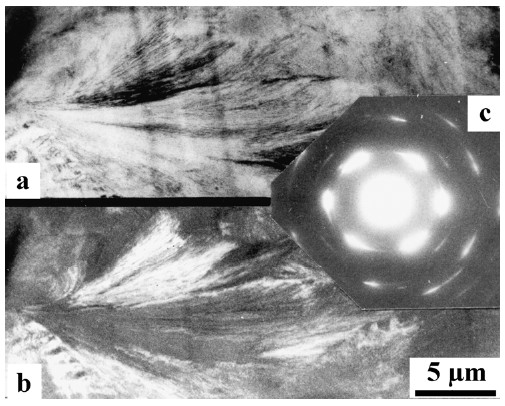
Elektronenstrahlen werden in analoger Weise wie die Röntgenstrahlen an kristallinen Proben nach dem BRAGG'schen Gesetz gebeugt. Wie bei der Röntgenbeugung kann man auch hier zwischen Einkristall- und Vielkristalldiagrammen unterscheiden. Erstere sind aus einzelnen Beugungspunkten bestehende Punktdiagramme, Vielkristalldiagramme dagegen sind Ringdiagramme (DEBYE-SCHERRER-Ringe). Aus beiden Diagrammtypen kann man die Gitterparameter bzw. die Netzebenenabstände der Probe bestimmen. Aus Einkristalldiagrammen kann man zusätzlich die kristallografische Orientierung des Kristalls identifizieren. Unter Nutzung des Beugungskontrastes sind Hellfeld- und Dunkelfeldaufnahmen möglich, die Informationen über die räumliche Anordnung kristalliner Strukturen liefern (Bild 4).
| Bild 4: | Kristalline Strukturen in einer Garbenmorphologie von Polyethylen niedriger Dichte (Kurzzeichen: PE-LD) a) im Hellfeld b) im Dunkelfeld c) im Elektronenbeugungsdiagramm |
Wesentliche Unterschiede der Elektronenbeugung gegenüber der Röntgenbeugung bestehen in den deutlich kleineren Beugungswinkeln als Folge der kleineren Wellenlänge der Elektronenstrahlen, der wesentlich größeren Intensität der Reflexe und einem deutlich kleineren erfassten Probenvolumen bei der Untersuchung. Die Auswertung der Elektronenbeugung an teilkristallinen Polymerproben erweist sich oftmals als recht kompliziert, da die kristallinen Strukturen durch den Elektronenstrahl innerhalb kürzester Zeiten zerstört werden.
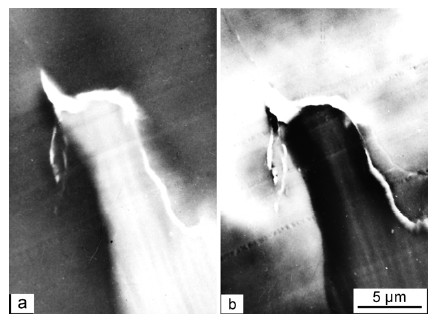
Gegenüber dem kristallinen Hellfeld kann das Dunkelfeld mitunter klarere Informationen liefern, wie Bild 5 zeigt: im Hellfeld (a) sind Scharten vom Schneideprozess her als störende Linien (Massendickenkontrast) vorhanden, die im Dunkelfeld (b) vermieden werden.
| Bild 5: | Dieselbe Stelle eines gebänderten Sphärolith in Polyethylen hoher Dichte (Kurzzeichen: PE-HD) im HEM [15] a) Hellfeldbild mit deutlichen Schneideartefakten (Kratzern) b) Dunkelfeldbild mit unterdrückten, nicht mehr sichtbaren Artefakten |
Energiefilternde TEM
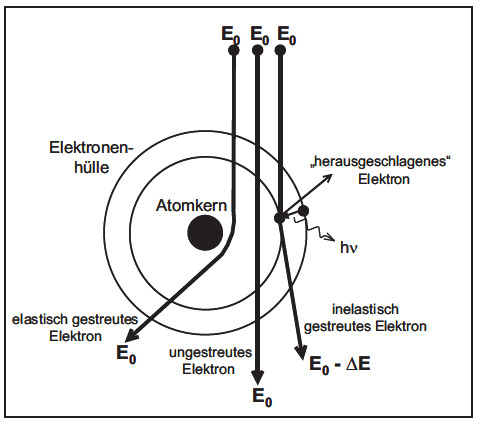
Für die konventionelle Transmissionselektronenmikroskopie haben sowohl aus methodischer als auch aus gerätetechnischer Sicht nur elastische Streuprozesse der abbildenden Elektronen in der Probe Bedeutung. Durch inelastische Wechselwirkungen, bei denen Elektronen des Elektronenstrahls nicht nur eine Richtungsänderung erfahren, sondern auch einen Energieverlust erleiden (Bild 6), gehen diese Elektronen dem Abbildungsprozess verloren, da ihre Energien und Wellenlängen nicht mehr auf die eingestellten Parameter der Linsen und Korrektoren abgestimmt sind. Deshalb erzeugen die inelastisch gestreuten Elektronen im Bild lediglich einen diffusen Streuuntergrund und verringern damit den Bildkontrast und auch das Auflösungsvermögen.
| Bild 6: | Schematische Darstellung der Wechselwirkungen der Elektronen mit den Atomen der Probe |
Neben der konventionellen Transmissionselektronenmikroskopie gewinnt seit einigen Jahren die „Analytische Transmissionselektronenmikroskopie“ immer mehr an Bedeutung. Hierzu werden Transmissionselektronenmikroskope mit analytischen Zusatzeinrichtungen ausgerüstet, die es ermöglichen, zusätzlich zur vergrößerten Abbildung die inelastischen Wechselwirkungen gezielt für einen Informationsgewinn und zur lokalen chemischen Analyse auszunutzen.
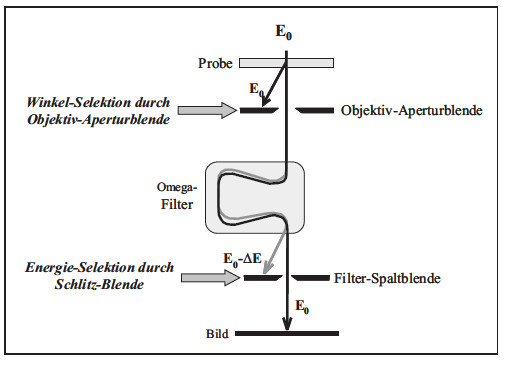
Besonders gut ist dafür die Elektronenenergieverlustspektroskopie (EELS) geeignet, mit der alle chemischen Elemente (außer Wasserstoff und Helium) in sehr kleinen Probenbereichen bis zu einigen Nanometern analysiert werden können. Diese Methode bildet zugleich die physikalische Grundlage für die energiefilternde Elektronenmikroskopie (EFTEM), die gerätetechnisch in den letzten Jahren eine stürmische Entwicklung zeigte. In der Praxis haben sich Filtersysteme der Firmen Gatan („Gatan Imaging Filter“ - GIF) und LEO („Omega“-Filter) durchgesetzt. Ausgangspunkt für die Entwicklung der EFTEM war der Wunsch, die in der Probe inelastisch gestreuten Elektronen vom Abbildungsprozess auszuschließen (Bild 7).
| Bild 7: | Prinzip der energiefilternden TEM (Omega-Filter), bei der inelastisch gestreute Elektronen vom Abbildungsprozess ausgeschlossen werden (Zero-Loss-Abbildung) |
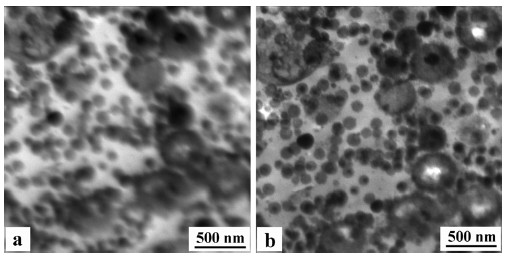
Die unterschiedlichen Wechselwirkungen der Elektronen mit der Probe ergeben ein Energieverlust-Spektrum, dass durch verschiedene Verlustmechanismen charakterisiert wird. Als ein Beispiel demonstriert Bild 8 einen Vorteil der Zero-Loss-Abbildung: Da im allgemeinen TEM-Proben sehr dünn sein müssen, gelangt eine Vielzahl von Elektronen ohne jegliche inelastische Wechselwirkung durch die Probe. Diese haben auch nach dem Passieren der Probe dieselbe Energie, wie sie sie nach dem Beschleuniger im TEM hatten. Ihr Energieverlust ist gleich Null (Zero-Loss). Damit können z. B. auch in einem TEM mit nur 120 kV Beschleunigungsspannung und Energiefilter Proben mit einer mehrfachen Dicke gegenüber einem konventionellen TEM noch gut abgebildet werden.
| Bild 8: | TEM – Aufnahmen eines kontrastierten 400 nm dicken Schnittes von Acrylnitril-Butadien-Styrol (Kurzzeichen: ABS) a) konventionelle Abbildung b) mit Elektronenenergie-Filterung, Zero-Loss Abbildung [1, 3] |
Strahlbeeinflussung und Objektschädigung
Durch die Elektronenbestrahlung werden vor allem Polymere und andere organische Materialien mehr oder weniger stark geschädigt. Primärprozesse bei einer energiereichen Bestrahlung (neben Elektronen auch γ-Bestrahlung u. a.) sind die Ionisierung und das Aufbrechen chemischer Bindungen. Sekundäreffekte sind hauptsätzlich Kettenspaltung eventuell mit Masseverlust (Desorption), Verlust der Kristallinität, Vernetzungen, Probenerwärmung, elektrische Aufladungen bis zu Probenbewegungen. Als Faustregel für Polymere gilt, dass eine umso stärkere Bestrahlungsempfindlichkeit vorliegt, je geringer der Kohlenstoffanteil im Polymer ist: die Empfindlichkeit nimmt in der Reihenfolge Polystyren (Kurzzeichen: PS), Polyethylen (Kurzzeichen: PE), Polycarbonat (Kurzzeichen: PC), Polymethylmethacrylat (Kurzzeichen: PMMA), Polyvinylchlorid (Kurzzeichen: PVC) und Polytetraflourethylen (Kurzzeichen: PTFE) zu. Kettenspaltung dominiert z. B. bei PC, PMMA und PTFE, während PS und PE dominierend Kettenvernetzung zeigen. In teilkristallinen Polymeren erfolgen diese Prozesse verstärkt in den amorphen Anteilen und verzögert in den kristallinen Lamellen. Da es sich um Schädigungen auf der molekularen Ebene handelt, muss dadurch die Morphologieanalyse nicht beeinträchtigt werden. Nicht selten tragen bestrahlungsinduzierte Materialschädigungen sogar zu einer vorteilhaften Kontrastverbesserung bei. Als Beispiele für solche „bestrahlungsinduzierten Kontrastverbesserungen“ seien selektive Vernetzungen in teilkristallinen Polymeren und Massenverluste in amorphen Polymeren (Bild 9, mit selektivem Masseverlust in der PVC-Phase) genannt.
| Bild 9: | Unterscheidbarkeit der beiden Kunststoffphasen in einer PVC/SAN-Mischung durch unterschiedlichen Masseverlust infolge der Elektronenbestrahlung a) Beginn der Bestrahlung: PVC dunkler als Styrol-Acrylnitril (Kurzzeichen: SAN) b) Nach intensiverer Bestrahlung: PVC heller als SAN (Semidünnschnitte im 1000 kV HEM) [15] |
Die Schädigungsgeschwindigkeit im Elektronenmikroskop kann durch einige experimentelle Möglichkeiten reduziert werden [16 – 18]:
- Kühlung der Proben im Mikroskop; dabei bringt eine Kühlung auf Stickstofftemperatur nur einen geringen Gewinn, während eine Kühlung auf Heliumtemperatur in einem Kryo- Elektronenmikroskop Verbesserungen der Lebensdauer von ein bis zwei Größenordnungen bewirken kann.
- Masseverlust und Aufladung lassen sich durch eine dünne aufgedampfte Kohlenstoff-Schicht reduzieren.
- Mit Zunahme der Beschleunigungsspannung der Elektronen nimmt die Schädigung ab; sie sinkt beim Übergang von 50 kV auf 100 kV auf die Hälfte und beim Übergang von 100 kV auf 1 MV auf ein Drittel.
- Eine Aufzeichnung der Bilder mit hochempfindlichem Photomaterial oder einer empfindlichen Kamera kann ebenfalls die Strahlbelastung reduzieren.
- Die Bestrahlungsintensität lässt sich auch durch eine Beobachtung bei geringer Helligkeit mit gut adaptierten Augen und mit der sogenannten „low-dose“ Technik (an einer Probenstelle fokussieren und an einer Nachbarstelle fotografieren) reduzieren.
Wie stark störend sich die Bestrahlungsschädigung bemerkbar macht, hängt außer von den Untersuchungsbedingungen auch von der Art des Materials und dem Untersuchungsziel ab. So interessiert in amorphen Polymeren vor allem die Morphologie, die durch die molekularen Prozesse während der Bestrahlung im Allgemeinen nicht oder nur geringfügig verändert wird. In teilkristallinen organischen Materialien wird zwar die kristalline Struktur relativ schnell zerstört (Verschwinden der Beugungsreflexe), aber die amorph-kristalline Anordnung muss nicht verändert, sondern kann sogar im Kontrast verstärkt wiedergegeben werden.
Bildverarbeitung und Bildanalyse
Die Bildverarbeitung und -analyse hat das Ziel, mittels spezieller Hard- und Software die Bildinformationen einer z. B. mikroskopischen Aufnahme zu verändern, so dass sowohl die Bildqualität verbessert wird als auch quantitative Informationen zu Strukturdetails bestimmt werden können.
Voraussetzung für die Bildverarbeitung ist ein digitalisiertes Bild. Dieses Bild kann auf verschiedene Weise gewonnen werden. Neue Elektronenmikroskope (TEM und REM) sowie Rasterkraftmikroskope erlauben es, die Bilder sofort digital aufzunehmen und zu speichern. Bei älteren Mikroskopen ist oft der Umweg über das Digitalisieren einer Fotovorlage mittels Digitalkamera oder Scanner notwendig.
Entscheidend für die Qualität eines digitalisierten Bildes sind die Bildauflösung (Anzahl der Bildpunkte - Pixel) und die verwendete Bit-Tiefe für jeden einzelnen Bildpunkt (z. B. jedem Pixel eines 8-Bit-Grauwertbildes können 256 Grauwerte zugeordnet werden). Die Anzahl der möglichen Bildpunkte wird durch die Aufnahmetechnik (z. B. Bildpunktzahl der Kamera) als auch durch die zur Verfügung stehende Speicherkapazität bestimmt.
Moderne Transmissionselektronenmikroskope mit CCD-Kamera erlauben es, Bilder mit einer Auflösung von 2024 x 2024 Pixel (2k x 2k - Kamera) und Rasterelektronenmikroskope mit bis zu 4048 x 4048 Pixel aufzunehmen. Die Bit-Tiefe variiert meist zwischen 8 und 16 Bit. Die Speicherung der Bilder kann in verschiedenen Dateiformaten erfolgen, wobei man zwischen Pixel- und Vektor-Formaten einerseits sowie unkomprimierten und komprimierten Formaten andererseits unterscheidet. In der Mikroskopie wird meist das unkomprimierte pixelorientierte TIFF-Format verwendet, da es alle Bildinformationen enthält und besonders für eine weitere Bearbeitung geeignet ist. Auf die Vielzahl weiterer gängiger Bildformate, wie sie z. B. in der Fotografie oder der computergestützten Konstruktion verwendet werden, soll hier nicht näher eingegangen werden. Obwohl inzwischen leistungsfähige Rechentechnik und Medien mit hoher Speicherkapazität (Festplatte, CD-ROM, DVD, ...) zur Verfügung stehen, ist die Diskussion über die Zuverlässigkeit einer Langzeitspeicherung noch nicht abgeschlossen.
Nach der Bildaufnahme und Digitalisierung schließt sich die Bildverarbeitung an, die die Bildqualität (Grauwerte, Kontrast, gleichmäßige Helligkeit, ...) verbessern soll und das Bild für die Bildanalyse optimiert. Diese Optimierung umfasst z. B. eine Shading-Korrektur (Ausgleich eines inhomogenen Bildhintergrundes) und bestimmte Filterungen (Schärfe, Hochpass, Tiefpass, ...) als auch arithmetische Operationen (Addition, Multiplikation, logische Verknüpfungen, ...).
Durch die Verwendung spezieller Filteroperatoren können einzelne Strukturdetails hervorgehoben bzw. abgeschwächt werden. Ein Tiefpass (z. B. Gauß-Filter) lässt den Eindruck eines Bildes weicher erscheinen, Grauwertkanten werden verwischt und Details bzw. Rauschen abgeschwächt. Ein Hochpass führt zu einem härteren Bildcharakter, hebt feine Details (z. B. Kanten) hervor, und homogene Bildbereiche werden gelöscht – Beispiele zeigt Bild 10.
| Bild 10: | Beispiel für die Bildveränderung durch Filteroperatoren a) TEM Aufnahme eines Polyethylen hoher Dichte (Kurzzeichen: PE-HD) b) Tiefpass c) Hochpass |
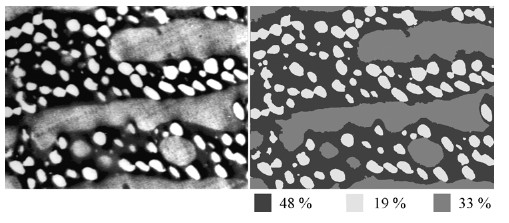
Die sich anschließende Bildanalyse dient dazu, bestimmte interessierende Bildinformationen (Phasenanteile, Partikelgrößen, Partikelabstände, Intensitätsprofile ...) quantitativ zu bestimmen. Können die zu vermessenden Bildinformationen vom Bilduntergrund separiert werden (Grauwerttrennung und Binarisierung), ist eine automatische Bildanalyse meist möglich. Oft sind vor allem TEM-Aufnahmen aber nur interaktiv, dass heißt durch Markieren der Bilddetails mittels Mauszeiger, auswertbar. An den folgenden zwei Beispielen sollen prinzipielle Möglichkeiten der Bestimmung von Strukturdetails vorgestellt werden. Bild 11 zeigt die Bestimmung von Phasenanteilen in einem Blend auf der Basis von Polyamid (Kurzzeichen: PA). Durch Definition von Grauwertbereichen eines Bildes, die entsprechende Phasenanteile widerspiegeln, kann bei bekannter Kalibrierung des Bildes der Phasenanteil bestimmt werden.
| Bild 11: | TEM-Aufnahme eines Polyamidblend (links) und Bestimmung der Phasenanteile durch Zuordnung definierter Grauwerte zu den einzelnen Phasenanteilen (rechts) |
Probenpräparation
Die dünnen und ultradünnen Proben für das TEM werden im Falle der Kunststoffe überwiegend mit der Ultramikrotomie hergestellt [1, 3].
Ein Ultramikrotom ist ein empfindliches Schneideinstrument, in dem eine Probe an einem feststehenden Messer aus Glas oder Diamant vorbeigeführt wird (Bild 12). Der Probenarm mit daran befestigtem Probenhalter und Probe wird bei jedem Zyklus um einen bestimmten, einstellbaren Betrag in Richtung auf das Messer bewegt.
| Bild 12: | Schematische Darstellung der Relativbewegung von Probe und Messer beim Schneidevorgang (A–Vorschub, B–Rückzug des Probearms) [3] |
Während des Schneidevorganges wird von der Probe ein Schnitt in der Dicke des Vorschubes erzeugt. Die genaue Schnittdicke wird außer durch den eingestellten Vorschub wesentlich auch durch andere Parameter wie Messerart, -qualität und -winkel sowie durch Probenmaterial und Schnittgröße bestimmt. Das Schneiden erfolgt mit einer in einem weiten Bereich einstellbaren Schneidegeschwindigkeit, welche abhängig vom Probenmaterial und der Schnittgeometrie optimiert werden muss. Die Rückführung der Probe geschieht mit einer von der Schneidegeschwindigkeit abhängigen Geschwindigkeit in der Art, dass die Zeit für einen Gesamtzyklus konstant ist.
Die Ultramikrotome können mit thermischem oder mit mechanischem Vorschub des Probenarms versehen sein. Der thermische Vorschub basiert auf dem physikalischen Prinzip der Thermo-Expansion. Der Halterarm wird an einer Seite fixiert, so dass bei dessen Erwärmung die Ausdehnung nur zur Seite des befestigten Präparates wirksam wird, d. h. also in Richtung des Messers. Der in modernen Geräten benutzte mechanische Vorschub basiert auf einem Feinmechaniksystem mit Schrittmotor. Der mechanische Vorschub kann genau eingestellt werden, so dass theoretisch Schnittdicken von 0 μm bis zu einigen Mikrometern möglich wären. Die wirkliche Schnittdicke ist aber von dem zu schneidenden Material und den eingestellten Parametern abhängig.
Die erhaltenen Schnitte werden zumeist in einem mit Flüssigkeit gefüllten Trog des Messers aufgefangen, anschließend auf Trägernetzchen aufgenommen und im Mikroskop untersucht. Moderne Geräte sind mit Videokameras zur Demonstration und mit Computern zur Dokumentation z. B. der Schneideparameter ausgestattet.
Wichtig für ein schnelles und sauberes Arbeiten ist die einfache und rasche Umrüstung des Ultramikrotoms zum Kryo-Ultramikrotom durch Aufsetzen der Kühlkammer auf die Gehäuseschale. Damit können Probe und Messer getrennt gekühlt werden. Während die Probenkühlung je nach Material bis zu etwa –185 °C eingestellt werden kann, reicht für das Messer eine geringere Kühlung aus. Für die Untersuchung biologischer Proben bzw. feuchter Polymerproben auch im gefrorenen Zustand im Elektronenmikroskop ist eine Kryotransfereinrichtung erforderlich.
Zum Schneiden werden entweder selbst hergestellte Glasmesser oder Diamantmesser verwendet. Beide Messerarten haben ihre Berechtigung. Welche Messer in welchen Konfigurationen verwendet werden, hängt neben der Frage des Preises auch vom Probenmaterial ab.
Wie bereits erwähnt, ist für weiche Kunststoffe eine Härtung bzw. Fixierung und generell für Kunststoffe eine Kontrasterhöhung erforderlich. Dies erfolgt zumeist durch eine Behandlung mit Chemikalien, wie Osmiumtetroxid, Rutheniumtetroxid u.a. (siehe Bilder 3 und 10). Alternativ kann eine Kontrastverstärkung auch durch physikalische Effekte erfolgen. Erfolgreich sind dabei eine bestrahlungsinduzierte Kontrastverstärkung (siehe Bild 13) und eine dehnungsinduzierte Kontrastverstärkung (siehe Bild 14).
| Bild 13: | Kontrastverstärkung in teilkistallinem PE-LD durch eine γ-Bestrahlung mit einer Dosis von 20 MGy a) gebänderte Sphärolithstruktur b) Lamellen innerhalb der konzentrischen Bänder [1, 15] |
| Bild 14: | Domänenstruktur in einem SAN-Kunststoff, sichtbar gemacht durch den Effekt einer dehnungsinduzierten Kontrastverstärkung [2, 15] |
In-situ-Mikroskopie
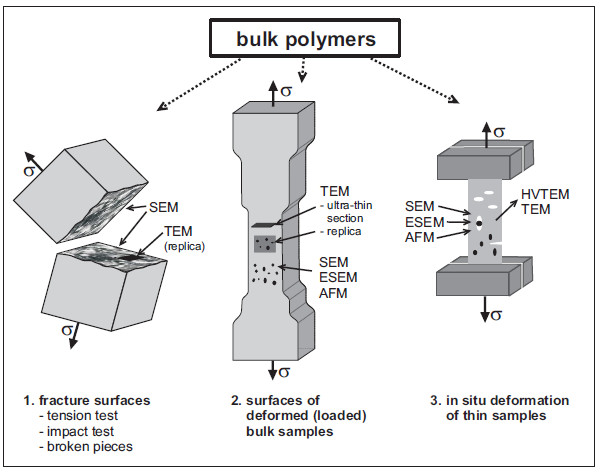
Die Vielfalt der strukturellen Details in Kunststoffen bedingt eine Mannigfaltigkeit in den nano- und mikromechanischen Prozessen unter Belastung. Diese umfassen Veränderungen auf der Ebene der Makromoleküle (auf der nm-Skala), lokalisierte plastische Prozesse wie Crazing und Scherfließen (auf der μm-Ebene) bis zu Rissausbreitung und dem makroskopischen Bruch (auf der mm-Ebene). Daher gibt es verschiedene Techniken zur Untersuchung dieser Prozesse, die in Bild 15 skizziert sind. Es gibt drei Hauptrichtungen:
| 1. Untersuchung von Bruchflächen (von Dehn- oder Bruchtests, Schadensfällen u. dgl.) direkt im REM oder im TEM mittels – der älteren – Abdrucktechnik |
| 2. Deformation kompakter Materialien und Untersuchung der Oberflächenveränderungen oder von Dünnschnitten im TEM |
| 3. Deformation dünner Filme oder Schnitte in einer speziellen Miniatur-Dehnvorrichtung für TEM, HEM, REM oder AFM, insbesondere in-situ-Dehntests (siehe: In-situ-Ultramikrotomie). |
Insbesondere die dritte Methodik ermöglicht dehnungsabhängige Materialveränderungen mit der konkrete Morphologie zu kombinieren und somit auf sehr direkte Weise Struktur-Eigenschafts-Beziehungen abzuleiten und materialwissenschaftlich zu begründen. Ein Beispiel gibt Bild 16 mit den Deformationsstrukturen in einem schlagzähen Polystyrol (Kurzzeichen: PS-HI) aus einem in-situ-Deformationstest im 1000 kV HEM wieder [15]. Zahlreiche weitere Beispiele finden sich in [1, 2, 5, 15].
| Bild 15: | Überblick über elektronenmikroskopische Methoden zur Untersuchung nano- und mikromechanischer Prozesse [1, 2, 15] |
| Bild 16: | In-situ-Deformation eines kautschukmodifizierten schlagzähen Polystyrols (Kurzzeichen: PS-HI); 2 μm dicker Schnitt deformiert im 1000 kV HEM; Dehnungsrichtung siehe Pfeil |
Literaturhinweise
| [1] | Michler, G. H.: Electron Microscopy of Polymers. Springer Verlag, Berlin Heidelberg (2008) (ISBN 978-3-54036350-7; siehe AMK-Büchersammlung unter F 1) |
| [2] | Michler, G. H., Balta-Calleja, F. J.: Nano- and Micromechanics of Polymers: Structure Modification and Improvement of Properties. Carl Hanser Verlag, München (2012) (ISBN 978-3-4462767-9; siehe AMK-Büchersammlung unter F 13) |
| [3] | Michler, G. H., Lebek, W.: Ultramikrotomie in der Materialforschung. Carl Hanser Verlag, München (2004) (ISBN 3-446-22721-0; siehe AMK-Büchersammlung unter F 5) |
| [4] | Michler, G. H.: Ultramicrotomy 15 (1984) 81–100 |
| [5] | Bethge, H., Heydenreich, J.: (Eds.) Electron Microscopy in Solid State Physics. Elsevier Sci. Publ. Amsterdam (1987) |
| [6] | Goodhew, P. J., Humphreys, F. J., Beanland, R.: Electron Microscopy and Analysis. 3rd Edn., Taylor & Francis, London (2000) |
| [7] | Zhang, X.-F., Zhang, Z.: (Eds.) Progress in Transmission Electron Microscopy, 1: Concepts and Techniques. Springer, Berlin (2001) |
| [8] | Li, Zh. R. (Ed.): Industrial Application of Electron Microscopy. Marcel Dekker Inc., New York (2003) |
| [11] | Magonov, S. N.: In: Meyers, R. A. (Ed.) Encyclopedia of Analytical Chemistry. Wiley, Chichester, UK, (2000) 7432 |
| [12] | Schönherr, H., Vancso, G. J.: Scanning Force Microscopy of Polymers. Springer Verlag, Berlin Heidelberg (2010) |
| [13] | Poelt, P., Ingolic, E., Gahleitner, M., Bernreitner, K., Geymayer, W.: Characterization of Modified Polypropylene by Scanning Electron Microscopy. J. Appl. Polym. Sci. 78 (2000) 1152–1161 |
| [14] | Karger-Kocsis, J. (Ed.): Polypropylene: Structure, Blends and Composites. Vol.1: Structure and Morphology. Chapman & Hall, London (1995) |
| [15] | Michler, G. H.: Kunststoff-Mikromechanik: Morphologie, Deformations- und Bruchmechanismen, Hanser Verlag, München (1992) (ISBN 3-446-17068-5; siehe AMK-Büchersammlung unter F 4) |
| [16] | in [1], Chapter 8, S. 175–183 |
| [17] | Michler, G. H.: Electron Microscopic Investigations of Morphology and Structure. Formation of Polymers. J. Macromolecular Sci.-Physics B 35 (1996) 329–355 |
| [18] | Michler, G. H., Dietzsch, Ch.: Investigation of Crystalline Polymeric Solids at Reduced Beam Damage in the High Voltage Electron Microscopy. Crystal Res. & Technol. 17 (1982) 1241–1254 |
| [19] | Michler, G. H.: Elektronenmikroskopie in Halle (Saale) – Stand, Perspektiven, Anwendungen. Heinz-Bethge-Stiftung für angewandte Elektronenmikroskopie Halle (Saale), (2017) |